PROCEDURE DU CONTRÔLE TECHNIQUE A L’IMPORTATION DES ACCESSOIRES MEDICAUX, PRODUITS ALIMENTAIRES ET PRODUITS COSMETIQUES
26 Janvier 2023 : Avis : Mesures transitoires concernant la mise en conformité des dispositifs médicaux au nouveau Règlement UE 2017/745
1-Objet et domaine d’application :
Cette procédure couvre les activités de contrôle technique à l’importation des :
dispositifs médicaux
produits dentaires ;
produits cosmétiques dispensés exclusivement en Pharmacie;
produits destinés à une alimentation particulière et compléments alimentaires ;
filtre d’hémodialyse ;
substituts du lait maternel et produits apparentés ;
matières premières destinées à l’industrie pharmaceutique.
2-Références réglementaires :
Décret n° 94-1744 du 29 Août 1994, relatif aux modalités de contrôle technique à l’importation et à l’exportation et aux organismes habilités à l’exercer.
Arrêté du Ministre de l’Economie Nationale du 30 Août 1994, fixant les listes des produits soumis au contrôle technique à l’importation et à l’exportation.
Arrêté du Ministre du Commerce et de l’artisanat, du 15 septembre 2005, portant modification de l’arrêté du Ministre de l’Economie Nationale du 30 Août 1994, fixant les listes des produits soumis au contrôle technique à l’importation et à l’exportation.
Décret N°84-1314 du 3 novembre 1984, fixant les attributions la composition et le mode de fonctionnement de la Commission Nationale pour la promotion de l’alimentation du nourrisson et de l’enfant.
Décision du Ministre de la Santé Publique en date du 06 Août 1994 relative aux conditions d’agrément des filtres d’hémodialyse.
Manuel des procédures de la DPM relatif au contrôle Technique à l’Importation
3- Procédures :
Dossier de la demande de l’autorisation de mise à la consommation :
Le dossier doit comporter les pièces suivantes :
Demande d’autorisation de mise à la consommation ou d’autorisation provisoire d’enlèvement signée par l’importateur ou son représentant avec un engagement de ne pas vendre la marchandise avant l’obtention de l’autorisation de mise à la consommation.
Facture d’achat où facture proforma.
Liste de colisage avec n°de lot
Dossier technique du produit.
Certificat de stérilité du lot pour les articles stériles.
Certificat de conformité du lot.
Certificat d’origine attesté par la chambre du commerce du pays d’origine.
Timbre fiscal d’un montant de 3 dinars (lors de retrait).
Les services techniques concernés peuvent demander tout autre document jugé nécessaire.
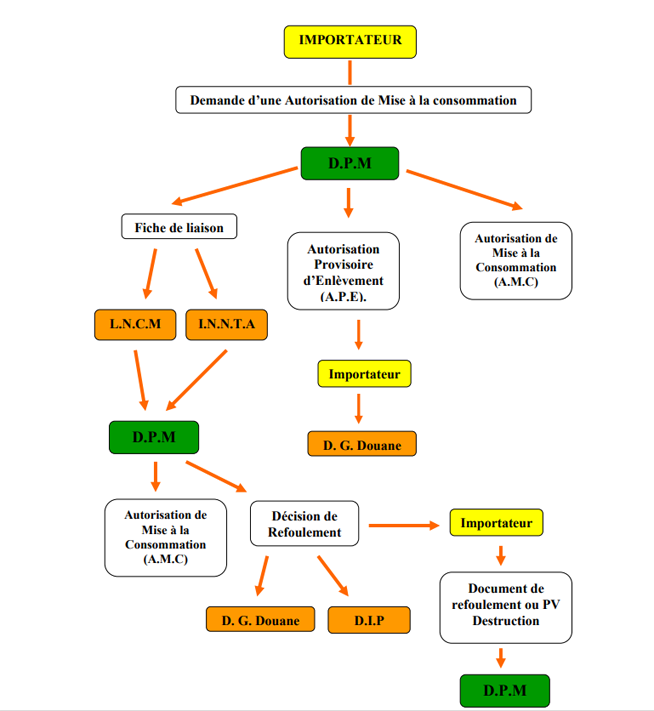
Recevabilité de la demande :
Le pharmacien chargé du contrôle technique reçoit les demandes directement de la part des importateurs qui se présentent à la D.P.M. Il procède aux vérifications suivantes :
appartenance du produit, objet de la demande, aux domaines d’application des produits soumis à la procédure du contrôle technique à l’importation de la DPM
le dossier de la demande comporte toutes les pièces nécessaires déjà citées ; en cas de non conformité, le pharmacien chargé du contrôle technique informe l’importateur et lui remet son dossier.
Traitement des demandes de mise à la consommation :
Chaque article importé est soumis à un contrôle systématique (analyse ou avis) selon le type de produit conformément à la liste A.
La Direction de la Pharmacie et du Médicament délivre soit :
o une autorisation d’enlèvement provisoire après étude du dossier dans les 48 heures.
o Une AMC directe pour :
les matières premières destinées à l’industrie pharmaceutique
les lots déjà contrôlés
o Une AMC après contrôle au LNCM ou INNTA, le contrôle nécessite un délai d’environ 1 mois.
4-Principaux documents :
Demande d’autorisation de mise à la consommation
Autorisation provisoire d’enlèvement
Fiche de liaison avec le LNCM / INNTA
Bulletins d’analyses
Autorisation de mise à la consommation
Décision de refoulement